Ústav experimentálnej onkológie
Vás pozýva na
Deň otvorených dverí
organizovaný pri príležitosti
Týždňa vedy a techniky na Slovensku 2014
v stredu 12. novembra 2014
od 9.00 do 12.00 hod
v ÚEO SAV na Vlárskej ulici 7 v Bratislave
so zaujímavým programom
SÚŤAŽ MLADÝCH ONKOLÓGOV 2014
ktorá sa uskutoční v dňoch 6. - 7. marca 2014
v prednáškovej sále Ústavu experimentálnej onkológie SAV
PROGRAM
štvrtok 6. 3. 2014
11.30 - 11.45 Registrácia
11.45 - 12.00 Slávnostné otvorenie súťaže
12.00 - 13.45 kategória Študent strednej školy zoznam príspevkov...
14.45 - 16.00 kategória Mladý výskumník do 35 rokov s ukončeným PhD štúdiom viac...
piatok 7. 3. 2014
8.30 - 8.45 Registrácia
8.45 - 15.15 kategória Mladý výskumník, doktorand zoznam príspevkov...
Vedecké dielne - Onkológia 2014
IV. ročník popularizačno-odborných seminárov na tému
Výskum rakoviny - v čom sme pokročili?
Ústav experimentálnej onkológie SAV a Nadácia Výskum rakoviny organizujú vo februári a marci 2014 štvrtý ročník vedeckých dielní v onkológii (VDO) pre študentov gymnázií na celom Slovensku, viac...
Osobnosť vedy a techniky SR 2013
Minister školstva, vedy, výskumu a športu SR Dušan Čaplovič vyznamenal v kategórii Osobnosť vedy a techniky
Mgr. Miroslava Chovanca, PhD.
Cenou ministra školstva, vedy, výskumu a športu SR za výskum mechanizmov opravy klinicky relevantných poškodení DNA.

GRATULUJEME!
Deň otvorených dverí ÚEO SAV - DOD2013
sa uskutočnil dňa 13. novembra 2013
v priestoroch ústavu na Vlárskej 7
Na podujatí sa zúčastnili študenti a ich učitelia zo štyroch bratislavských gymnázií - L. Novomeského, prof. A. Letková; J. Papánka, prof. B. Miklošová; Metodova, prof. A. Košiarová, Evanjelického lýcea, prof. J. Alexyová a Súkromného gymnázia Žilina, prof. M. Poliaková. V prvom bloku si študenti vypočuli informácie o zaujímavých prístrojoch, ktoré sa používajú na ÚEO SAV vo výskume – Incucyte (Essen Bioscience, projekt Nadácie Výskum rakoviny), ImageStream (Amnis, projekt Transmed 2) a PyroMark sekvenátor (Qiagen, projekt Nadácie Výskum rakoviny). V druhej časti si študenti vyskúšali zručnosť pri experimentálnej práci. Potom mohli vidieť zariadenia v činnosti a klásť zvedavé otázky zamestnancom a doktorandom ústavu.
 viac...
viac...
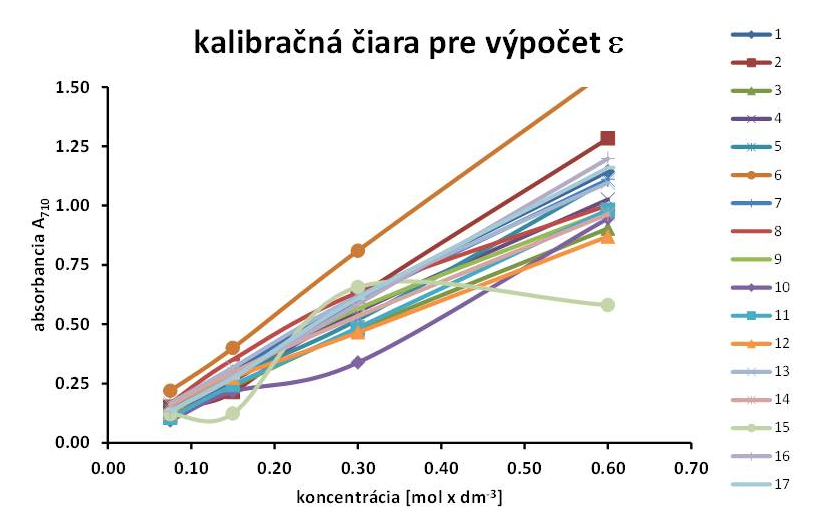
Graf: Náhodná vzorka výsledkov súťaže zručnosti na presnosť pipetovania
PROGRAM DOD2013:
- pre verejnosť od 14.00 do 15.40 hod (program tu)
- a dva turnusy pre pozvané gymnáziá od 9.00 hod a od 10.30 hod; info: alena.gabelova@savba.sk
- súťaž pre študentov (info materiál, pomôcky)
- Incucyte, PyroMark sekvenátor, ImageStream
V popoludňajšej časti pre verejnosť odzneli prednášky o špičkových zariadeniach a účastníci si pripomenuli 20. výročie vzniku Nadácie Výskum rakoviny, ktorá oficiálne odovzdala ústavu do užívania meracie zariadenie Nanosight.
Tento prístroj je výsledkom projektu Beh pre život, ktorého 6. ročník sa konal v tomto roku v slovenských mestách. Pripomenuli sme si aj ďalšie aktivity nadácie ako sú Súťaž mladých onkológov, Deň výskumu rakoviny, popularizačný projekt ústavu a nadácie Vedecké dielne Onkológia, či Zápas pre život na štadióne v Prievidzi, kde hrali mužstvá Nadácie, Mufuzy, Starí páni Prievidza a Internacionáli.
K dobrej nálade prispel svojim vystúpením Tomáš Bezdeda, i keď v mužstve Mufuzy ako súper, teraz ako priateľ Nadácie.


Ďakujeme.
Vyznamenanie za celoživotné dielo
Slovenská akadémia vied ocenila pri príležitosti svojho 60. výročia významné osobnosti, ktoré sa zaslúžili o jej rozvoj. Za ÚEO SAV boli oceneni:
MUDr. Viliam Ujházy, DrSc. a Ing. Veronika Altanerová, CSc.

Obom oceneným blahoželáme, ďakujeme za celoživotný vklad do vedeckého poznania
a želáme aj naďalej pevné zdravie.
GRATULUJEME!
NEOPLASMA
časopis pre experimentálnu a klinickú onkológiu
v roku jubilejného 60. ročníka zaviedla online prijímanie rukopisov implementáciou redakčného systému MMPlus pre celý proces redakčnej činnosti, a to aj vďaka podpore Ligy proti rakovine.
Špičkové tímy aj na ÚEO SAV
Dňa 3. júla 2013 SAV ocenila špičkové vedecké tímy, ktoré identifikovala Akademická ratingová a rankingová agentúra (ARRA) na základe analýzy verejne dostupných databáz vedeckých výstupov. Medzi ocenenými (zoznam) boli aj dva kolektívy z nášho ústavu:
tím pod vedením doc. Ing. Čestmíra Altanera, DrSc. a
tím pod vedením RNDr. Jána Sedláka, DrSc.
Všetkým oceneným gratulujeme.
STANOVISKO
vedenia ÚEO SAV k mimopracovnej aktivite zamestnanca >>

projekt pod záštitou prezidenta SR - J.E. Ivana Gašparoviča
s podporou Slovenskej rektorskej konferencie
a pod odbornou garanciou Slovenskej akadémie vied






HOT TOPICS IN CANCER ~ HORÚCE NOVINKY ZO SVETA
Bunky zdravých jedincov normálne obsahujú 46 chromozómov a dve kópie každého génu. Ľudia s Downovým syndrómom však majú navyše jednu kópiu chromozómu 21, čo znamená, že nesú až tri kópie všetkých 231 génov nachádzajúcich sa na tomto chromozóme, a medzi inými aj génu DSCR1 (Down´s syndrome candidate region-1). Vedci predpokladajú, že zvýšená expresia práve tohto génu potláča signálne dráhy, ktoré niektoré typy nádorov využívajú pre spustenie angiogenézy. Gén DSCR1 totiž kóduje proteín, ktorý potláča angiogénnu signalizáciu sprostredkovanú VEGF (vascular endothelial growth factor) prostredníctovm kalcineurínovej cesty.
Vedci testovali regulačný efekt DSCR1 u normálnych a Ts65Dn myší, ktorým boli podané pľúcne a kožné nádorové bunky. Ts65Dn myši predstavujú myší model pre Downov syndróm a majú tri kópie 104 génov z 231 génov na ľudskom chromozóme 21, medzi ktorými je aj gén DSCR1.
Výsledky štúdie ukázali, že Ts65Dn myši mali po podaní pľúcnych a kožných nádorových buniek o 50% znížený rast nádorov ako normálne myši po 3-4 týždňoch. Vedci sa preto ďalej snažili priamo dokázať úlohu DSCR1 použitím myší, ktoré mali len tri kópie génu DCSR1 a normálny počet všetkých ostatných génov na chromozóme 21. U takýchto myší bol rast nádorov po 3 týždňoch opäť o 50% nižší ako u kontrolnych, čo naznačuje, že práve DSCR1 je z veľkej časti zodpovedný za potlačnie rastu nádorov. Následne vedci skúmali, či aj iné gény umiestnené na chromozóme 21 sa podieľajú na potlačení rastu nádoru a preto použili Ts65Dn myši, ktoré mali normálny počet kópii génu DSCR1 ale tri kópie všetkých ostatných génov na chromozóme 21. U týchto myší bolo pozorované asi 25% zníženie rastu nádorov v porovnaní s kontrolnymi myšami. To teda dokazuje, že hoci je gén DSCR1 veľmi dôležitý pri potláčaní rastu nádoru, nie je jediným génom, ktorý sa toho zúčastňuje. Následnými pokusmi na myších bunkách rastúcich na kultivačných miskách sa im podarilo zistiť, že zvýšená expresia génu DSCR1 v kombinácii so zvýšenou expresiou ďalšieho génu nachádzajúceho sa na chromozóme 21, DYRK1A, potláča angiogenézu a rast nádoru. Vedcom sa teda podarilo zistiť, že potlačenie kalcineurínovej aktivity produktom DSCR1 génu spolu s génom DYRK1A na chromozóme 21, môže byť dostatočné na výrazné potlačenie angiogenézy. Výsledkom štúdie teda je odhalenie mechanizmu, ktorý sa podieľa na zníženej incidencii nádorov u pacientov s Downovým syndrómom a identifikácia kalcineurínovej signálnej dráhy a jej regulátorov (DSCR1 a DYRK1A) ako potenciálnych cieľov pri terapii nádorov.
Spracovala: Katarína Együdová
Pre výrobu nových chemopreventívnych liekov, pomáhajúcich v boji proti rakovine, sú veľmi dôležité zvieracie modelové systémy ako napr. APCMin myši, ktoré predstavujú vhodný modelový objekt pre štúdium kolorektálneho karcinómu. APCMin myši majú chemicky indukovanú mutáciu v kodóne 850, ktorý tak isto býva mutovaný u pacientov s familiárnou adenomatóznou polypózou. Nevýhodou testovania nových potenciálnych chemopreventívnych liekov na hlodavcoch je experimentálna a časová náročnosť testovania. Testovanie jednej látky na APCMin myšiach trvá približne 18 týždňov, a preto je potrebné vyvinúť nový systém, ktorý by umožňoval rýchly skríning testovaných látok.
APC10.1 predstavuje novú bunkovú líniu derivovanú z APCMin myší, ktorá nesie mutáciu v kodóne 850 v heterozygotnom stave a vykazuje skorý neoplastický fenotyp. Táto bunková línia reprezentuje nový in vitro model, ktorý spolu s in vivo štúdiami na APCMin myšiach, môže prispieť k lepšiemu pochopeniu familiárnej adenomatóznej polypózy a k objaveniu nového terapeutického prístupu. Úspešnosť pôsobenia tej ktorej látky sa hodnotí jej inhibičným účinkom na rast APC10.1 buniek in vitro a inhibíciou tvorby adenómov u APCMin myší in vivo. Použitie APC10.1 bunkových línií ako predbežných indikátorov chemopreventívnej aktivity môže výrazne redukovať množstvo štúdií na APCMin myšiach vylúčením neúčinných látok a zvyšuje šancu na nájdenie sľubných chemopreventívnych liečiv.
Podľa zdroja: Sale, S – Fong, IL - de Giovanni, C – Landuzzi, L – Brown, K – Steward, WP – Gescher, AJ. 2009. APC10.1 cells as a model for assessing the efficacy of potential chemopreventive agents in the Apc(Min) mouse model in vivo. Eur J Cancer. 2009 Aug 18. [Epub ahead of print] spracovala Lenka Wachsmannová
Defekty v ubikvitin–závislej proteolýze a taktiež v ubikvitinovej signalizácii boli zistené pri mnohých ľudských ochoreniach, vrátane rakoviny, neurodegeneratívnych ochorení a metabolických porúch. V prípade rakoviny môže ubikvitinový systém spôsobiť misreguláciu signálnych dráh, alebo môže spôsobovať zmeny v degradácii kritických regulátorov bunkového cyklu. Napríklad nesprávne fungovanie ubikvitin–závislej proteolýzy môže mať za následok zosilnenie účinku onkoproteínov, alebo redukovať množstvo tumor supresorových proteínov. Z tohto dôvodu sa začína uvažovať o využití „ubikvitinovej mašinérii“ ako o možnom cieli protinádorovej terapie. Dôkazom správnosti tohto prístupu je aj úspešnosť využívania inhibítorov proteazómu pri niektorých typoch rakoviny, ako napr. u mnohopočetného myelómu. Nevýhodou týchto inhibítorov je to, že pôsobia len na jednu funkciu ubikvitinového systému - na degradáciu proteínov a nepôsobia na signalizačnú funkciu tohto systému, ktorá môže byť tak isto dôležitá v procesu tumorigenézy ako je degradačná funkcia.
Ubikvitinácia v ubikvitin-dependentnom proteázomálnom systéme je trojkrokový proces, ktorý je katalyzovaný ubikvitin aktivujúcim enzýmom (E1), ubikvitin viažucim enzýmom (E2) a ubikvitin ligázou (E3). V bunkách väčšiny eukaryotických organizmov býva jeden typ enzýmu E1, viac ako desať typov enzýmu E2 a stovky rôznych enzýmov E3. Každý E2 a E3 rozoznáva len niektoré cieľové proteíny. E3 navyše môžu interagovať len s niektorými enzýmami E2. To zabezpečuje mimoriadnu špecificitu ubikvitinácie. Pre úspešnosť terapeutického využitia ubikvitinovej dráhy je potrebné zostaviť presný atlas opisujúci, ktorá E3 je zmenená v ktorom type rakoviny. Práca vedcov pod vedením doktora Confalonieri poskytla prvý náčrt takéhoto atlasu s vyznačenými možnými cieľmi protinádorovej terapie a podporila ideu, že špecifické inhibítory ubikvitin ligázy môžu byť účinné u rozsiahlej skupiny ľudských nádorov.
Podľa zdroja: Confalonieri, S - Quarto, M - Goisis, G - Nuciforo, P - Donzelli, M – Jodice, G - Pelosi, G - Viale, G –Pece, S - Di Fiore, PP. 2009. Alterations of ubiquitin ligases in human cancer and their association with the natural history of the tumor. Oncogene 28: 2959-2968 spracovala Lenka Wachsmannová
Tímu kanadských vedcov pod vedením Dr. Guy Sauvageau z Institute for Research in Immunology and Cancer (IRIC) at Université de Montréal sa úspešne podarilo vyprodukovať vysoké množstvo laboratórnych krvných kmeňových buniek z malého množstva kmeňových buniek získaných z kostnej drene. Každoročne len v Severnej Amerike takmer 4 000 ľudí nepodstúpi potrebnú transplantáciu kostnej drene kvôli nedostatku kompatibilných darcov. Alternatívou chýbajúcej kostnej drene sú práve krvné kmeňové bunky kostnej drene, ktoré sú schopné regenerovať kostnú dreň príjemcu, no ich hlavným obmedzením je ich nedostatočný počet v krvných bankách.
Vedci z laboratória Dr. Sauvageau identifikovali zo 700 kandidátnych proteínov 18 nukleárnych faktorov, ktoré ovplyvňujú aktivitu krvných kmeňových buniek. Nadexpresiou desiatich nukleárnych faktorov sa v myšiach dosiahla zvýšená repopulačná aktivita kmeňových buniek kostnej drene, v porovnaní s neopracovanými krvnými kmeňovými bunkami. Ďalším pokračovaním experimentov bude štúdium celého procesu opracovania krvných kmeňových buniek u ľudí, pričom do testovania budú zapojení pacienti nemocnice Montreal's Maisonneuve-Rosemont Hospital, čo je jedno z vedúcich centier Kanady zamerané na transplantáciu kmeňových buniek. Taktiež sa predpokladá, že po vylepšení procesu opracovania krvných kmeňových buniek v laboratóriu sa bude v budúcnosti získavať dostatočné množstvo (nielen) krvných kmeňových buniek z pupočníkovej krvi.
Vedci na celom svete v súčasnosti využívajú regeneratívnu silu krvných kmeňových buniek hlavne na liečbu relabujúcich leukémií rezistentných voči chemoterapii. Taktiež mnohé štúdie na myšiach ukazujú, že transplantácia kompatibilných krvných kmeňových buniek kostnej drene darcu zabraňuje odmietnutiu transplantovaného orgánu u príjemcu.
Podľa zdroja: Eric Deneault, Sonia Cellot, Amélie Faubert, Jean-Philippe Laverdure, Mélanie Fréchette, Jalila Chagraoui, Nadine Mayotte, Martin Sauvageau, Stephen B. Ting and Guy Sauvageau: A Functional Screen to Identify Novel Effectors of Hematopoietic Stem Cell Activity. Cell, Volume 137, Issue 2, 17 April 2009, Pages 369-379.
spracovala: Michaela Fajtová
B bunky (B lymfocyty) sú bunky ľudského imunitného systému produkujúce protilátky, ktoré v organizme vyhľadávajú a viažu cudzorodé antigény. Folikulárny lymfóm je malígna choroba B buniek, ktoré sa vo folikuloch lymfatických uzlín vyvíjajú, nekontrolovane delia a tak dávajú vznik nádoru. Keďže sú potomkami jednej patologickej bunky, všetky produkujú na svojom povrchu rovnaké protilátky – idiotypy, ktoré slúžia ako špecifické biomarkery charakteristické pre každého pacienta. Súčasťou vakcíny BiovaxID sú práve presné kópie týchto špecifických idiotypov. Získavajú sa pomocou hybridómovej techniky, pri ktorej sa pacientské B bunky získané z tumoru pri biopsii fúzujú s heteromyelómovou bunkovou líniou. Idiotypy prítomné vo vakcíne stimulujú T bunky imunitného systému (bunky zamerané sa na ničenie rakovinových buniek), ktoré vyhľadávajú iba patologické B bunky s daným idiotypom. Vďaka tomu, že vakcína spúšťa prirodzené obranné mechanizmy organizmu voči nádoru, nie sú zatiaľ známe žiadne vedľajšie účinky, ktoré sú spojené s tradične využívanými liečebnými technikami - chemoterapiou a s rádioterapiou.
Vedci taktiež veria, že vakcína zabezpečí úplnú imunitnú odpoveď voči rakovinovým bunkám aj pri opätovnom objavení sa choroby (relapse). BiovaxID bol pôvodne navrhnutý na liečbu folikulárneho non-Hodgkinovho lymfómu, ukazuje sa však, že možno ho využiť aj v liečbe lymfómu z plášťových buniek (mantle cell lymphoma), chronickej lymfoidnej leukémie a mnohopočetného myelómu.
Vývoj vakcíny BiovaxID sa začal už v roku 1986 a v roku 2000 National Cancer Institute (USA) povolil jeho vstup do III. fázy klinických testov. V súčasnosti sa podáva dobrovoľným pacientom vo viacerých Európskych krajinách. Pacientom zahrnutým v klinických pokusoch urobia pred podávaním chemoterapie alebo terapiou monoklonálnymi protilátkami biopsiu lymfatickej uzliny. Vakcína sa podáva po 6 mesiacoch od ukončenia chemoterapie a pozostáva z 5 vakcinácií BiovaxID mesačne.
Výsledky fázy III. klinických testov autori prezentovali na plenárnej výročnej schôdzi American Society of Clinical Oncology (ASCO; 29.5 – 2.6.2009) a získali hodnotenie „Best of ASCO“. Klinické štúdie fázy III. ukazujú, že vakcína BiovaxID signifikantne predlžuje prežitie pacientov z 30,6 mesiacov na 44,2 mesiacov, teda o 44%. Dodatočné vyšetrenie pacientov po 4,7 roku od ukončenia podávania vakcíny BiovaxID ukázalo, že pacienti mali o 38% nižšie riziko relapsu než pacienti, ktorí dostávali kontrolnú vakcínu. Terapia bola taktiež vyhodnotená ako bezpečná a dobre tolerovaná.
Podľa zdroja: S. J. Schuster, S. S. Neelapu, B. L. Gause, F. M. Muggia, J. P. Gockerman, E. M. Sotomayor, J. N. Winter, C. R. Flowers, A. M. Stergiou, L. W. Kwak for the BiovaxID Phase III Study Investigators. Idiotype vaccine therapy (BiovaxID) in follicular lymphoma in first complete remission: Phase III clinical trial results. J Clin Oncol (Meeting Abstracts) 2009 27: 2.
spracovala: Michaela Fajtová
Na overenie svojej domnienky sledoval so svojimi študentmi prejav génov v piatich rôznych tkanivách- v mozogu, semenníkoch, pečeni, obličkách a srdci. Objavili jednoznačné rozdiely v programovanej bunkovej smrti (apoptóze) mozgových buniek. Šimpanzie mozgové bunky umierali omnoho účinnejšie ako ľudské bunky. Toto výrazne dlhšie prežívanie neurónov nám pravdepodobne zabezpečilo zväčšovanie kapacity mozgu a rozvíjanie kognitívnych schopností.
Apoptóza je však najdôležitejším mechanizmom, ktorý zabezpečuje umieranie rakovinových buniek. U ľudí je obmedzená, vďaka čomu máme pravdepodobne vyššiu inteligenciu, no tým pádom je aj smrť rakovinových buniek menej efektívna. Tak ako je to u všetkých evolučných teórii, ani táto nemusí platiť úplne, no McDonald so svojim tímom potvrdili svojimi experimentmi, že schopnosť apoptózy v mozgu šimpanza je omnoho efektívnejšia ako u človeka, čo smeruje k potvrdeniu jeho hypotézy.
Programovaná bunková smrť teda stojí niekde uprostred. Bolo nevyhnutné ju obmedziť na to, aby sa ľudstvo vďaka svojej inteligencii stalo najdominantnejším živočíchom na zemi. Cena, ktorú za to platí, je pravdepodobne rakovina.
Podľa zdroja: Gaurav Arora, Nalini Polavarapu, John F. McDonald. Did natural selection for increased cognitive ability in humans lead to an elevated risk of cancer? Medical Hypotheses, 2009, in press spracovala Zuzana Mydlíková
Viac ako 50% nádorových ochorení je typických nefunkčným proteínom p53. Tento proteín zohráva jednu z hlavných úloh pri kontrole bunkového cyklu a v programovanej bunkovej smrti. Rakovinové tkanivo je charakterizované nekontrolovaným rastom a prežívaním týchto buniek, hoci by mali po vzniku poškodenia umierať. Nekontrolovaný rast a prežívanie rakovinových buniek spôsobuje vo veľkej miere práve nefunkčný proteín p53. Jedným z procesov znefunkčnenia proteínu je jeho predčasná degradácia, ktorá sa uskutoční prostredníctvom proteínu Mdm-2 tak, že označí proteín p53, aby bol rozložený. K degradácii p52 dôjde skôr, ako stihne zabrániť nekontrolovanému deleniu. Proteín Mdm-2 sa tvorí v mnohých rakovinových bunkách v nadmernom množstve, čo v nich spôsobí zvýšenú degradáciu p53.
Ďalšou dôležitou úlohou proteínu p53 je navodenie programovanej smrti buniek. K smrti rakovinových buniek, kde je proteín p53 nefunkčný, nedochádza. Snahou rôznych protinádorových terapií je nájsť látky, ktoré by navodzovali práve smrť rakovinových buniek cestou programovanej smrti. Jednou z mnohých takýchto látok by mohol byť proteín s názvom nutlin. Nutlin sa viaže na Mdm-2, čím zabráni nadmernému rozkladaniu p53, a tým sa zabezpečí jeho funkcia v navodení smrti buniek.
Tím pod vedením doktorky Vaseva odskúšal pôsobenie proteínu nutlin na bunkách akútnej myeloidnej leukémie a bunkách kolorektálneho karcinómu. Zistili, že po pôsobení nutlinu bol proteín p53 v bunkách stabilizovaný, čo viedlo k masívnej indukcii smrti rakovinových buniek. Nutlin sa preto po ďalších klinických testoch pravdepodobne bude môcť využiť v nastavení terapie pre pacientov s rakovinou, kde spolu s radioterapiou alebo chemoterapiou by mohol pomôcť k navodeniu smrti rakovinových buniek.
Podľa zdroja: Vaseva AV, Marchenko MD, Moll UM. The transcription-independent mitochondrial p53 program is a major contributor to nutlin-induced apoptosis in tumor cells. Cell Cycle 2009: 1711-1719 spracovala Zuzana Mydlíková
Vedci tesovali vyvinuté nanotyčinky na myšiach s vytvorenými nádormi. U myší, ktorým boli intravenózne podané nanotyčinky a následne podstúpili liečbu infračerveným svetlom, nádor zmizol v priebehu 15 dní. Liečené myši prežili až do konca trvania štúdie (3 mesiace) bez znovuobjavenia nádoru, kým myši ktoré neboli liečené alebo im boli aplikované len nanočastice alebo len svetelná dávka pomocou lasera uhynuli. Schopnosť nanotyčiniek usídliť sa v nádorovom tkanive predstavuje veľmi sľubný terapeutický nástroj v onkológii. Tento prístup môže byť využitý aj pre diagnostiku nádorov, kedy po podaní častíc môžu byť tieto zobrazené použitím špeciálnej techniky známej ako „Ramanov rozptyl“. Každé tkanivo okrem pečene a sleziny, ktoré bude emitovať svetelné žiarenie môže potencionálne obsahovať nádor. Predtým, ako vyvinuté a testované nanotyčinky budú môcť byť použité v humánnej medicíne, musia prejsť klinickými testami a byť schválené FDA (Food and Drug Administration).
Podľa zdroja: Geoffrey von Maltzahn, Ji-Ho Park, Amit Agrawal, Nanda Kishor Bandaru, Sarit K. Das, Michael J. Sailor and Sangeeta N. Bhatia: Computationally Guided Photothermal Tumor Therapy Using Long-Circulating Gold Nanorod Antennas. Cancer Research 69, 3892-3900 spracovala Katarína Együdová
Rakovina pľúc je jedným z najčastejších typov rakoviny u ľudí. Bola dokázaná jej spojitosť s pravidelným fajčením. Tabakový dym obsahuje veľké množstvo karcinogénov, ktoré zahŕňajú polycyklické aromatické uhľovodíky (PAU), N-nitrozamíny, kovy, rôzne organické zlúčeniny a voľné radikály, ktoré spôsobujú oxidačné poškodenie viacerých bunkových molekúl, vrátane DNA.
Počas evolúcie si bunky vyvinuli mechanizmy, ktoré odstraňujú poškodenie z DNA, a tak obnovujú jej pôvodný stav. DNA polymeráza lambda (pol lambda) je enzým, ktorý sa zúčastňuje opravy poškodených nukleotidov (mechanizmus bázovej excíznej opravy) ako aj opravy dvojvláknových zlomov DNA (nehomologické spájanie koncov). Zabezpečuje zapĺňanie vzniknutých medzier v DNA, a tak pomáha bunke vyrovnať sa s poškodením DNA.
Tím japonských vedcov pozoroval výskyt pol lambda v nádorových bunkách izolovaných z pacientov postihnutých rakovinou pľúc. I keď nezistili spojitosť medzi fajčením a pol lambda v bunkách tumoru, hladina pol lambda v okolitých zdravých bunkách priedušničkovej výstelky závisela od miery fajčenia pacientov. Ťažkí fajčiari mali v bunkách väčšie množstvo pol lambda ako slabší fajčiari. Vedci tiež pozorovali, že nádory, ktoré neexprimovali pol lambda, boli v pokročilejšom klinickom štádiu ako nádory s expresiou pol lambda. Tento enzým sa teda môže podieľať na opravných procesoch poškodení DNA zapríčinených fajčením vo výstelkových bunkách. Stanovenie hladiny expresie v normálnych bunkách u ťažkých fajčiarov s vysokým rizikom rozvoja rakoviny pľúc by mohlo slúžiť ako marker na predpoveď výskytu a vývoja rakoviny.
Podľa zdroja: T. Ohba, T. Kometani, F. Shoji, T. Yano, Y. Ichiro, K. Taguchi, I. Kuraoka, S. Oda, Y. Maehara, Expression of an X-family DNA Polymerase, pol lambda, in the Respiratory Epithelium of Non-Small Cell Lung Cancer Patiens with Habitual Smoking, Mutat Res. 2009 May 22 spracovala

