Komplex DNA ligáza IV-XRCC4 (Dnl4-Lif1)
DNA
ligáza IV a XRCC4 tvoria komplex (LX), ktorý je schopný spájať zlomené konce
DNA. Oba komponenty tohto komplexu majú u cicavcov dôležitý význam pre ich
vitalitu, pretože neprítomnosť ktoréhokoľvek z nich vedie k embryonálnej
letalite u myší. Bunky defektné v LX komplexe vykazujú citlivosť k
ionizujúcemu žiareniu, defektnú opravu DSB, poruchu vo V(D)J rekombinácii a
výraznú nestabilitu genómu spôsobujúcu vyššiu incidenciu nádorových ochorení
v organizmoch defektných v tomto komplexe. DNA ligáza IV je ATP-závislá DSB
DNA ligáza a XRCC4 je jej kofaktor, ktorý ju stabilizuje, zosilňuje jej
aktivitu a nasmerováva ju k miestu DSB. Dnl4 a Lif1 sú považované za
kvasinkové ekvivalenty ľudskej DNA ligázy IV a XRCC4, pretože Dnl4 je
ATP-závislá DSB DNA ligáza a Lif1 je jej stabilizujúci, stimulujúci a
nasmerovávací kofaktor. Podobným spôsobom ako DNA ligáza IV a XRCC4, Dnl4 a
Lif1 formujú vysoko stabilný komplex. Kvasinkový komplex má rovnaké
biochemické aktivity ako ľudský komplex.
LIG4 syndróm
LIG4
syndróm je vzácne autozomálne ochorenie vznikajúce v dôsledku mutácií v géne
pre DNA ligázu IV (LIG4). K
dnešnému dňu boli identifikovaní štrnásti LIG4 pacienti, z ktorých každý má
aspoň jednu mutáciu v LIG4 géne.
Jeden pacient má s mutáciou asociované aj dva polymorfizmy.
Charakterizácia mutácií a polymorfizmov u LIG4 pacientov
|
Pacient |
LIG4
genotyp |
Zmena v proteíne |
Stav |
|
1 (180BR) |
833 G→A |
R278H |
Homozygot |
|
2 (411BR) |
8 C→T,
26 C→T,
833 G→A |
A3V, T9I, R278H |
Homozygot |
|
3 (2303) a
4 (2304) |
1738 C→T,
2440 C→T |
R580X, R814X |
Heterozygot |
|
5 (99P0149) |
1406 G→A,
2440 C→T |
G469E, R814X |
Heterozygot |
|
6 (3703) |
2440 C→T |
R814X |
Homozygot |
|
7 a 8 |
839 A→G,
1270-1274 AAAAG
delécia |
Q280R, posun v čítacom rámci v pozícii K424 generujúci predčasný
STOP kodón |
Heterozygot |
|
9 (SC2) |
1297-1299 CAA delécia |
Delécia Q433 |
Homozygot |
|
10 a 11 |
845 A→T,
1270-1274 AAAAG
delécia |
H282L, K424 posun v čítacom rámci generujúci predčasný STOP kodón |
Homozygot |
|
12 |
745 A→G,
1270-1274 AAAAG
delécia |
M249V, K424 posun v čítacom rámci generujúci predčasný STOP kodón |
Heterozygot |
|
13 a 14 |
1762-1764 AAG delécia |
Delécia K588 |
Homozygot |
Nedávne štúdie indikujú, že závažnosť klinických príznakov odráža vplyv
mutačnej zmeny na funkciu proteínu. Konkrétne, DNA ligáza IV nesúca mutáciu
R278H exprimovaná v podmienkach in
vitro si zachováva vyššiu hladinu reziduálnej aktivity v porovnaní s DNA
ligázami IV nesúcimi mutačné zmeny, ktoré boli identifikované v pacientoch s
výraznejším klinickým prejavom (pacienti 3-5). Je preto pravdepodobné, že
mierne redukovaná aktivita DNA ligázy zabezpečuje dostatočný nervový a
imunitný vývoj, čo sa neprejaví žiadnym klinickým príznakom, ale vylučuje
normálu odpoveď na rádioterapiu, ktorá generuje vysoké množstvo DSB. Je
zaujímavé, že aj polymorfizmy (A3V a T9I) v DNA ligáze IV majú vplyv na
funkciu proteínu. Hoci ich efekt nie je dramatický v inak divom type
proteínu, ich vplyv je signifikantný, keď sú spriahnuté s R278H mutáciou a
pravdepodobne je zodpovedný za rozdiel v klinickej závažnosti medzi
jednotlivými LIG4 pacientmi. Toto je príklad, keď polymorfná zmena
ovplyvňuje funkciu proteínu s veľmi pravdepodobným klinickým vyústením.
Lokalizácia mutácií a polymorfizmov nájdených v pacientoch s LIG4 syndrómom
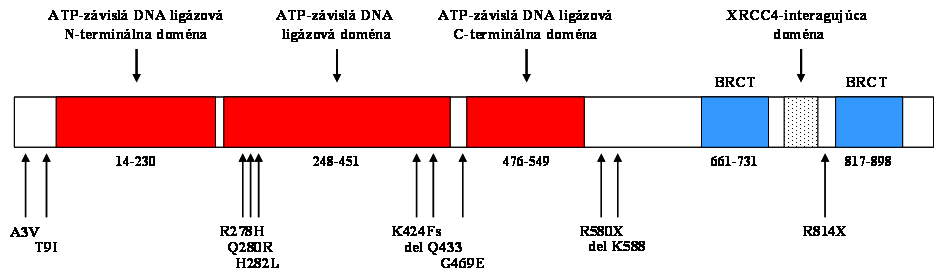
A3V
a T9I polymorfizmus a predispozícia k rakovine
Dedičné syndrómy sú spôsobené mutáciami, ktoré majú značný vplyv na funkciu
proteínu. Avšak menej závažné mutácie a polymorfizmy môžu takisto zapríčiniť
sporadické nádory. Na podporu tohto bolo ukázané, že dedičnosť
LIG4 A3V CT (heterozygot)
genotypu je signifikantne asociovaná s dvojnásobným poklesom risku ochorenia
na mnohopočetný myelóm, a dedičnosť
LIG4 T9I CT (heterozygot) a LIG4
T9I TT (homozygot) genotypov s jedenapolnásobným a štvornásobným poklesom
risku tohto ochorenia. Tieto údaje teda naznačujú, že
LIG4 A3V a T9I polymorfizmy majú
v prírode protektívny účinok a znižujú risk ochorenia na mnohopočetný myelóm.
Doposiaľ bolo nájdených 15 polymorfizmov v kódujúcej sekvencii
LIG4 génu, z ktorých
najfrekventovanejší je práve polymorfizmus
LIG4 T9I.
Naše
ciele
Hoci
sa podarilo identifikovať zopár polymorfizmov, ktoré majú vplyv na funkciu
proteínu, takéto štúdie sú častokrát limitované nedostatkom dostatočne
citlivých metód v podmienkach in vivo.
Napriek tomu bolo ukázané, že dva navzájom späté polymorfizmy v DNA ligáze
IV (A3V and T9I) majú mierny vplyv na funkciu proteínu v podmienkach
in vitro. Čo je však viac
významné je fakt, že keď sú tieto dva polymorfizmy späté s mutáciou R280H,
tak dochádza k aditívnemu vplyvu, čo má za následok závažnejší klinický
fenotyp spôsobený pravdepodobne redukovanou aktivitou proteínu pod hladinu,
ktorá je potrebná pre normálny vývoj (porovnaj pacientov 1 a 2). Tento fakt
poukazuje na to, že prítomnosť polymorfizmov môže výrazne ovplyvniť vývoj
jedinca. Okrem toho LIG4 A3V a
T9I polymorfizmy v neprítomnosti R280H mutácie znižujú riziko chromozomálnej
nestability a následnej malignancie, ako bolo pozorované pre mnohopočetný
myelóm.
Keďže oprava DNA má
vysoko konzervovaný charakter, komponenty v nej zahrnuté sú častokrát
schopné fungovať v heterológnych systémoch. V zhode s týmto boli kvasinky
S.
cerevisiae už niekoľkokrát
použité ako hostiteľ pre horizontálny prenos génov, ktoré kódujú enzýmy
a/alebo proteíny zahrnuté v oprave DNA u ľudí. Takéto štúdie viedli k
preskúmaniu biologických a biochemických vlastností mnohých
komponentov opravy DNA u ľudí.
Funkcia dvoch hlavných
komponentov ľudského NHEJ, KU70-KU80 a LX komplexov, je vysoko konzervovaná
počas evolúcie, hoci celková
sekvenčná identita korešpondujúcich homológov v kvasinkách a ľuďoch je skôr
nízka. Avšak bolo ukázané, že ľudský KU70 proteín je schopný funkčne
kompenzovať stratu Yku70, čo naznačuje, že poznatky o NHEJ získané v
kvasinkách môžu platiť aj pre ľudí, a že kvasinky môžu byť preto využité na
zodpovedanie základných otázok týkajúcich sa procesu NHEJ.
Ako
bolo spomenuté vyššie, v cicavčích bunkách je nedostatok citlivých
in vivo metód na stanovenie
vplyvu polymorfizmov na funkciu proteínu. Jeden z prístupov, ktorý by mohol
pomôcť vyriešiť tento problém je založený na použití modelových organizmov
ako je S.
cerevisiae, pre ktoré tieto
metódy môžu byť pomerne jednoducho zavedené. Toto je však postavené na
predpoklade, že polymorfné zmeny sú vysoko konzervované, čo nie je prípad
DNA ligázy IV a Dnl4. Tento problém by mohol obídený heterológnou expresiou
mutantných a polymorfných LX komplexov v kvasinkách. Takáto štúdia by mohla
priniesť do bližšej korelácie nedávno publikované údaje z
in vitro podmienok s detailnými
in vivo výsledkami získanými z
kvasiniek, hoci nejaké limitované in
vivo údaje z cicavčích buniek už sú k dispozícii. Ďalšia charakterizácia
ľudských mutantných a polymorfných LX komplexov v podmienkach
in vivo by mohla zvýšiť naše
vedomosti o vplyve mutácií a polymorfizmov na ľudské zdravie, špeciálne
incidenciu nádorov vyplývajúcu z menej účinného a/alebo presného procesu
NHEJ.
Ako postupujeme (aktualizované 19.5.2009)
V prvej etape riešenia projektu sme
skonštruovali kvasinkový kmeň, ktorý exprimuje ľudský LX komplex divého
typu. Ľudský LX komplex sme vniesli do kmeňa
S.
cerevisiae JKM 139 (MATa, hmrD::ADE1, hmlD::ADE1, ade1-100,
leu2-3,112, lys5,
trp1::hisG, ura3-52,
ade3::GAL-HO). Pomocou PCR reakcie sme si vytvorili disrupčnú kazetu,
ktorou sme vyradili kódujúcu oblasť
LIF1 génu URA3 selekčným
markerom, čím sme vytvorili lif1Δ0::URA3 derivát kmeňa JKM
139, ktorý sme označili AD 1392. Sekvenačnými reakciami sme overili
správnosť tohto kmeňa.

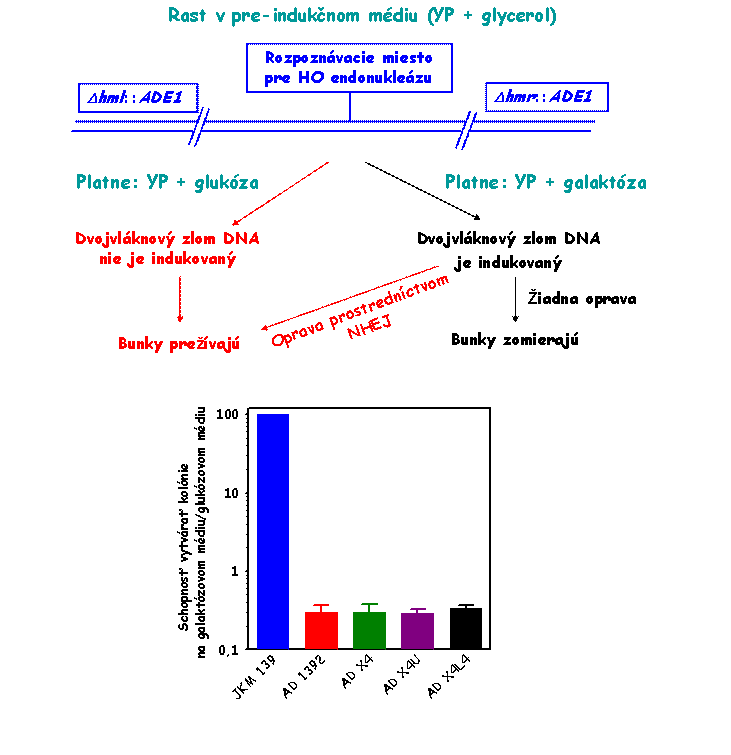
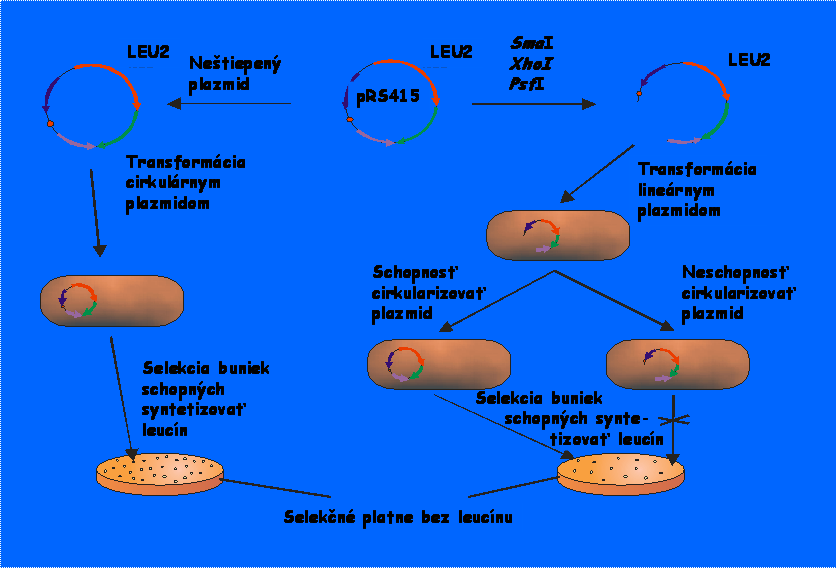
Fenotypicky sme vyradenie LIF1 génu v
kmeni AD 1392 overili stanovením schopnosti tohto kmeňa cirkularizovať
linearizovanú plazmidovú DNA (schéma
tohto stanovenia je uvedená na obrázku nižšie).
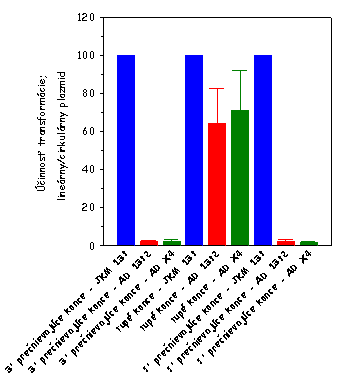
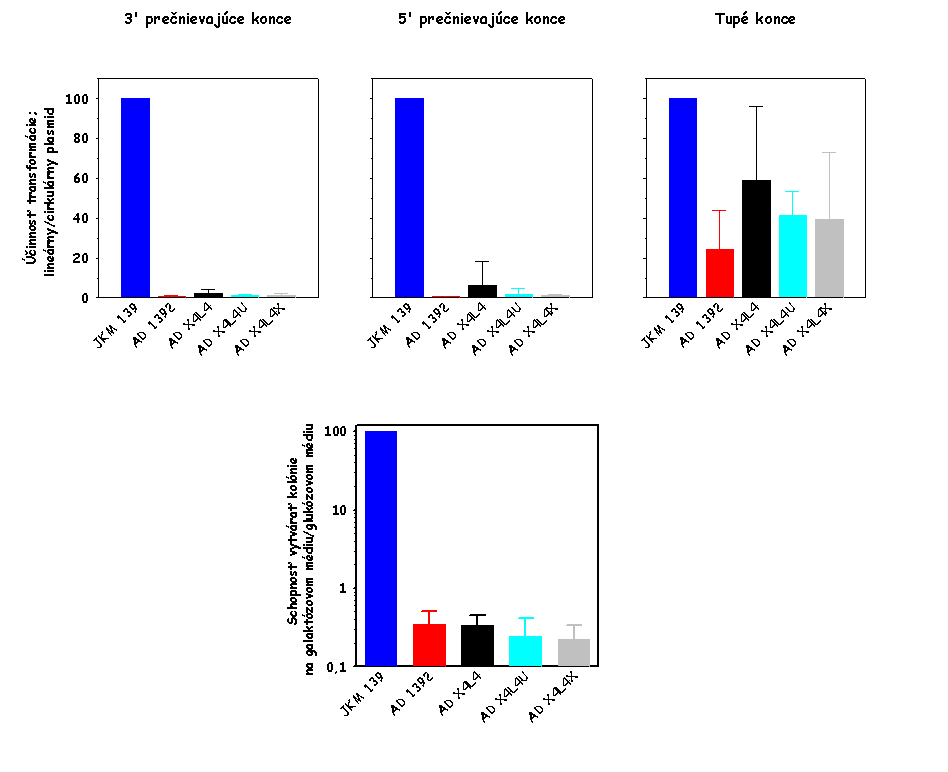
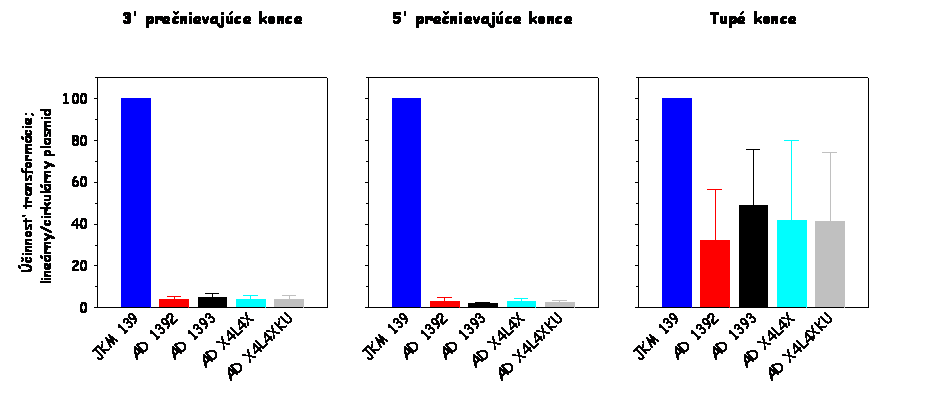
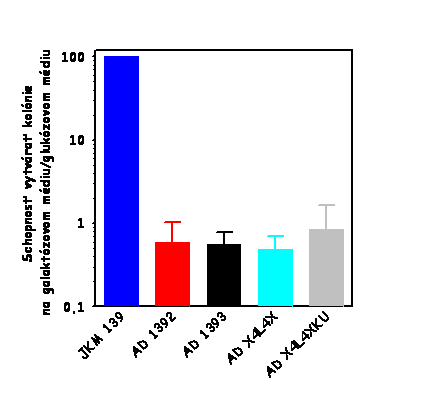
Výsledok tohto stanovenia je zobrazený na
nižšie uvedenom obrázku vľavo. Ako je evidentné, AD 1392 kmeň (lif1Δ0::URA3
derivát kmeňa JKM 139) je defektný v cirkularizácii plazmidovej DNA, čo
svedčí o jeho defekte v procese NHEJ v dôsledku disrupcie
LIF1 génu v tomto kmeni.
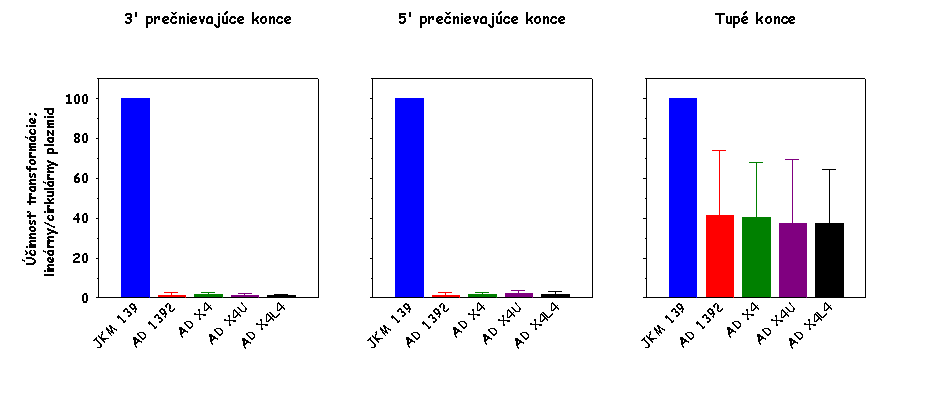
Plazmidová DNA bola štiepená takými restrikčnými endonukleázami, aby boli
generované nasledovné typy koncov DNA: 3' prečnievajúce konce, 5'
prečnievajúce konce a tupé konce. Výsledky pre
lif1Δ0::URA3
derivát sú normalizované k výsledkom získaným pre divý typ (JKM 139).
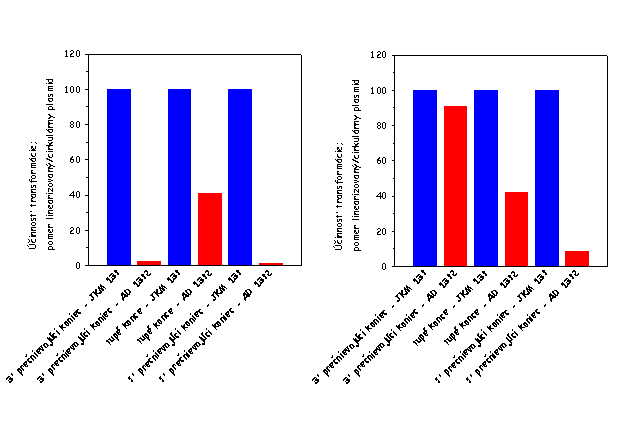
Pri závadzaní stanovenia schopnosti
kvasinkových kmeňov cirkularizovať linearizovanú plazmidovú DNA sme narazili
na niekoľko problémov, ktoré sa nám však podarilo postupne vyriešiť a
patrične zodpovedať ich podstatu. V prvých experimentoch sme neboli schopní
vidieť defekt kmeňa AD 1392 v procese cirkularizácie plazmidovej DNA
štiepenej restrikčnou endonukleázou generujúcou 3' prečnievajúce konce (viď
obrázok vyššie vpravo). Keď sme však použili na vytvorenie 3'
prečnievajúcich koncov inú restrikčnú endonukleázu, tento problém sme
odstránili (porovnaj obrázok vyššie vľavo a vpravo). Okrem toho sme
opakovane pozorovali len mierny defekt AD 1392 kmeňa v procese
cirkularizácie plazmidovej DNA štiepenej restrikčnou endonukleázou
generujúcou tupé konce (viď oba obrázky vyššie). Ako sme zistili, tento fakt
je spôsobený tým, že aj divý typ per
se účinnejšie cirkularizuje plazmidovú DNA s 3' a 5' prečnievajúci
koncami v porovnaní s tupými koncami (viď obrázok nižšie vľavo; výsledky pre
linearizované plamidy sú normalizované k údajom získaným pre cirkulárny
plazmid). Keď sa potom pri výpočtoch účinnosti cirkularizácie linearizovanej
plazmidovej DNA údaje získané pre bunky defektné v NHEJ normalizujú k údajom
získaným pre bunky divého typu, zohľadnením tohto faktu dostávame, že kmeň
defektný v NHEJ je len mierne defektný v procese cirkularizácie plazmidovej
DNA štiepenej restrikčnou endonukleázou generujúcou tupé konce. Testovali
sme, či aj iné kmene divého typu vykazujú defekt v cirkularizácii
plazmidovej DNA štiepenej restrikčnou endonukleázou generujúcou tupé konce.
Použili sme kmeň JKM 179, ktorý sa od kmeňa JKM 139 líši iba párovacím
typom, a kmeň W303, ktorý je úplne iného pôvodu. Výsledky týchto stanovení
sú ukázané na obrázku nižšie v strede a vpravo. Ako je evidentné, všetky
nami testované kmene divého typu vykazujú porovnateľný stupeň defektu v
cirkularizácii plazmidovej DNA s tupými koncami. Z toho vyplýva, že defekt v
cirkularizácii plazmidovej DNA štiepenej restrikčnou endonukleázou
generujúcou tupé konce je do určitého stupňa vlastný aj bunkám divého typu,
čo je v zhode s údajmi niektorých iných autorov. Určitý stupeň defektu v
cirkularizácii plazmidovej DNA s tupými koncami v bunkách divého typu budeme
musieť adekvátne v ďalších experimentoch zohľadniť.
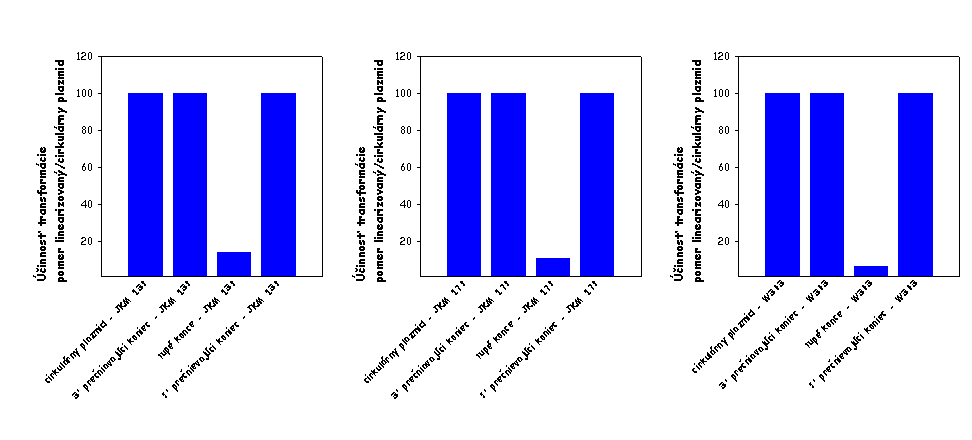
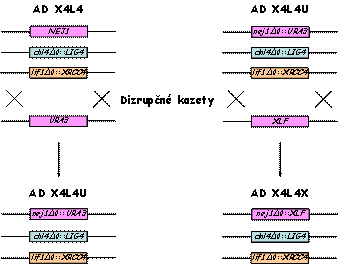
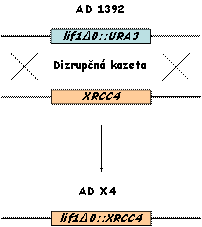
Následne sme do kmeňa AD 1392 vniesli
cDNA kódujúcu ľudský XRCC4 proteín podľa schémy uvedenej nižšie. Vytvorili
sme tak kmeň AD X4, ktorý je lif1Δ0::XRCC4
derivátom kmeňa JKM 139.
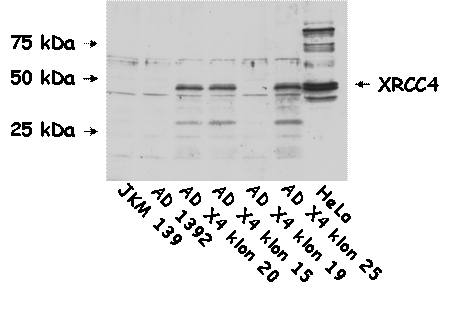
V kmeni AD X4 (v štyroch
nezávislých klonoch) sme overili expresiu ľudského XRCC4 proteínu anti-XRCC4
protilátkami (viď obrázok nižšie). Ako je evidentné, tri klony (20, 15 a 25)
exprimujú ľudský XRCC4 proteín. Klon 20 bol následne sekvenovaný, aby sa overila
sekvencia ľudskej XRCC4 cDNA.